Статья из журнала Nature в сокращении и переработке
Микробиом кишечника стал в последнее время актуальной темой биомедицинских исследований. Этому способствует непрерывное развитие аналитических методов. Оригинальные эксперименты на моделях животных показали влияние микробиоты кишечника на здоровье, а так же то, как нарушение ее состава может способствовать заболеваниям кишечника, и не только кишечника! Неудивительно, что связь между микробиотой и заболеваниями у людей — предмет значительного интереса. Однако участие микробиоты заболеваниях изучено мало при неполном понимании нами состава “здоровой” кишечной микробиоты.
За последние годы многое стало известно о роли наших бактерий кишечника в поддержании здоровья. Неудивительно, что клинические и лабораторные исследования были устремлены на изучение связей между микробиомом кишечника и различными заболеваниями. Первоначально, по очевидным причинам, основное внимание уделялось заболеваниям желудочно-кишечного тракта, где уже были отмечены примеры воздействия аномальной микробиоты кишечника, проявляющиеся кишечными инфекциями, заболеваниями, связанными с наличием хеликобактера пилори и антибиотик-ассоциированной диареей. За последнее десятилетие мы получили доказательства, подтверждающие связь кишечной микробиоты с широким спектром психоневрологических, иммунологических и аллергических заболеваний. К примеру, измененная микробиота была выявлена во множестве разнообразных расстройств, от болезни Паркинсона и аутизма до диабета, астмы и целиакии .
Таким образом, за очень короткий промежуток времени исследования микробиома сместились от лаборатории к клинической практике, где их потенциал в облегчении диагностики, определении прогноза и лечебной тактики вызвал интерес среди исследователей и биомедицинской индустрии.
В основе веры в клиническую применимость информации о микробиоме лежат три предположения:
во-первых, мы знаем, каков он, микробиом, в норме;
во-вторых, мы можем точно и воспроизводимо определить патологию, вызванную изменением микробиома;
в-третьих, мы можем установить биологически достоверные и клинически значимые взаимоотношения между выявленным микробным профилем и рассматриваемым заболеванием.
Что же является нормой?
Определены факторы, позволяющие оценить, в какой степени такие параметры, как характер и условия родоразрешения, грудное или искусственное вскармливание, сроки, географическое расположение, питание, физическая нагрузка, употребление алкоголя или антибиотиков и возраст могут повлиять на любое понимание “нормы”.
На сегодняшний день диета вполне может быть главным определяющим многих исследований микробиома человека. Для микробиоты важен не только общий характер модели диеты (например, веганы в сравнении с вегетарианцами и в сравнении с “мясоедами” или подвергнутая глубокой обработке западная пища в сравнении с сельской африканской), но и относительные количества конкретных компонентов (углеводы, белки, жиры, клетчатка), влияющих на энтеротипы.
Привычная диета может надолго обеспечить формирование микробиоты. Но и кратковременные изменения в рационе, например, у людей с желудочно-кишечными заболеваниями, в том случае, если они будут достаточно существенными, также могут повлиять на изменения бактериального разнообразия и энтеротипа кишечной экосистемы.
Влияние грудного молока на микробиоту новорожденных и старших детей, опосредованное его собственным бактериальным “населением”, а также олигосахаридами-пребиотиками, представляет собой еще один яркий пример воздействия факторов окружающей среды на становление энтеротипа микробиоты кишечника.
Вносить изменения могут и другие терапевтические агенты. Антибиотики — очевидные источники проблем. Хорошо описан эффект их различных терапевтических доз.
Менее регистрируемые, но потенциально гораздо более влияющие на микробиом кишечника изменения оказывают дозы антибиотиков, используемых в животноводстве, которые мы получаем с мясом животных и птицы, с яйцами, что описано на экспериментальных моделях животных. Поскольку с каждым днем все подробнее описываются изменения микробиоты кишечника, связанные с применением других лекарственных средств, нам следует подготовиться к неожиданностям.
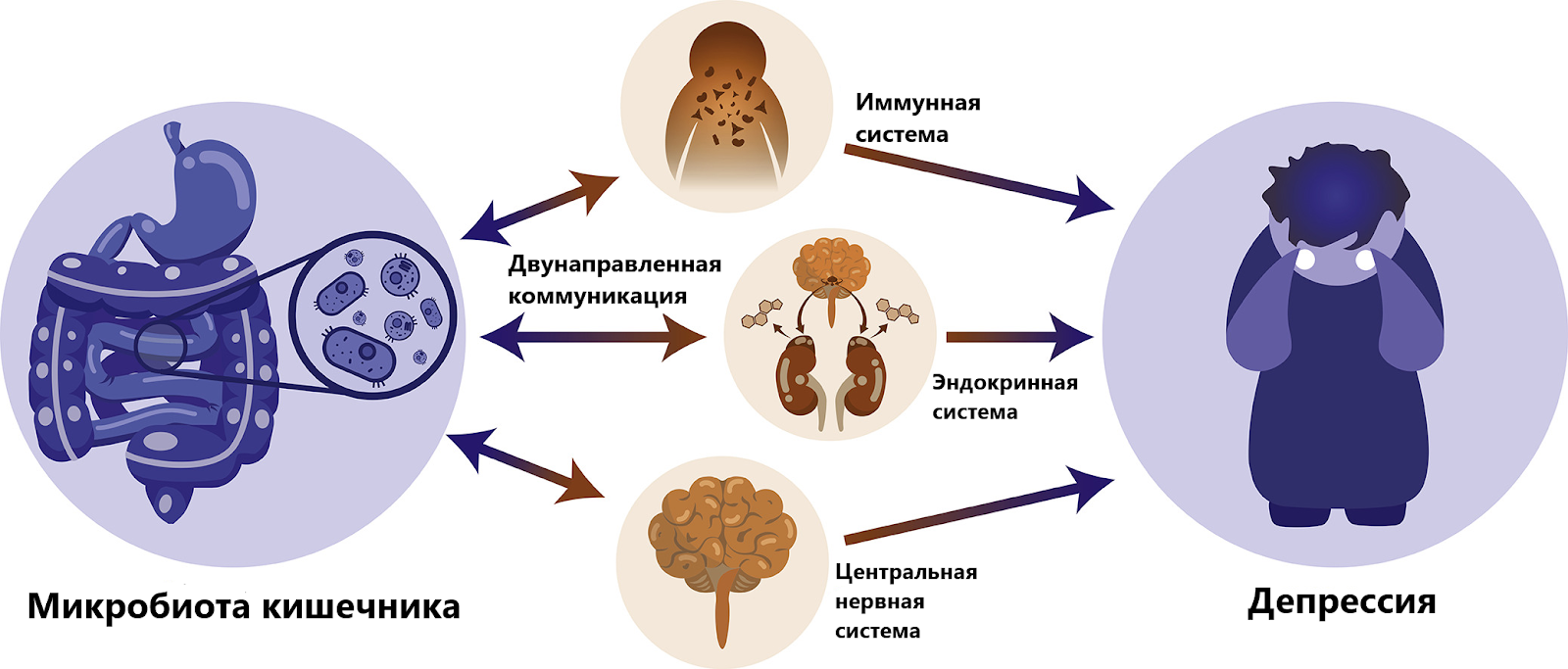
Следует также знать и помнить о существовании связи в человеке между кишечником и мозгом, так называемой осью микробиота-кишечник-мозг. Сейчас она рассматривается как имеющая взаимовлияние или двунаправленность, о чем свидетельствуют эффекты, которые оказывает стресс на физиологию кишечника, иммунитет и состав кишечной микробиоты.
Между микробиотой кишечника, кишечником (включая его иммунную и нервную системы, а также барьерную функцию) и мозгом происходит двунаправленное взаимодействие.
Роль микробиоты в желудочно-кишечных заболеваниях
На фундаментальном уровне многие из этих расстройств, видимо, связаны с переменным взаимодействием между нормальной и патологической микробиотой кишечника, продуктами микробного метаболизма, геномом хозяина (регулирующим такие факторы, как иммунный ответ), кишечным барьером (в широком смысле), иммунным ответом организма хозяина, его физиологией, а также с диетой и другими факторами микро- и макроокружения.
Учитывая, что многие из этих взаимодействий связаны и двунаправлены, не сложно оценить, с какими трудностями сталкивается исследователь, пытаясь понять роль микробиоты кишечника в возникновении изучаемого заболевания.
Однако был достигнут определенный прогресс.
Было показано, что характер взаимодействия между факторами патогенности бактерий, геномом хозяина и его иммунным ответом в значительной мере влияет на формирование фенотипа заболеваний, возникающих при инфицировании Helicobacter pylori, а также при связи как с болезнью Крона, так и с язвенным колитом.
Некоторые заболевания, по представлениям исследователей, “исходят ” из самого кишечника по причине нарушения его “герметичности”, то есть нарушения барьерной функции стенок кишечника.
В крайне упрощенном понимании, в нарушении барьерной функции кишечника часто обвиняются желудочно-кишечные и системные расстройства, вызываемые или опосредованные микробиотой, в том числе патологической.
Так называемое нарушение “герметичности кишки” способствует проникновению бактерий или продуктов их жизнедеятельности (например, липополисахаридов бактерий) через поврежденный эпителий в портальный или системный кровоток, что приводит к сепсису или системному иммунному ответу. Несмотря на привлекательность этой гипотезы, она имеет некоторые несоответствия. Главное: в отличие от животных моделей, методы выявления бактериальной транслокации (проникновения бактерий и продуктов их жизнедеятельности через стенку кишечника) у людей оказались ненадежными из-за методических ограничений.
Некоторые продукты метаболизма бактерий играют решающие роли в патогенезе симптомов и даже в этиологии кишечных и системных заболеваний.
Желчные кислоты обладают сложной и двунаправленной связью с кишечной микрофлорой. С одной стороны, желчные кислоты оказывают бактериостатическое влияние на некоторые микроорганизмы, а потому лактобациллы и бифидобактерии приспособились уклоняться от их воздействия с помощью фермента гидролазы желчных кислот.
С другой стороны, переработка бактериями первичных желчных кислот приводит к образованию продуктов, которые, благодаря непрерывно растущему многообразию регуляторных функций, могут оказывать влияние на метаболизм хозяина и на иммунный ответ, а также на моторику и секреторную активность толстой кишки.
Например, показано, что:
хенодезоксихолевая кислота ускоряет транспорт в толстой кишке, как и поступающая в кишечник желчь;
а такие желчные кислоты, как холевая, хенодезоксихолевая и дезоксихолевая способствуют экспрессии глюкагон-подобного пептида-1, тем самым усиливая секрецию инсулина и фермента деиодиназы 2 типа (главный фермент конверсии Т4 в Т3) и, таким образом, усиливая термогенез.
Таким образом, при конкретном желудочно-кишечном заболевании возможны множественные взаимодействия. Но определение относительной значимости эффектов этих взаимодействий, хотя это и возможно на биологических моделях, все еще трудно воспроизводимо или вовсе не осуществимо на людях.
Как доказательство: при изучении роли микробиоты кишечника при печеночной энцефалопатии (при возможно первичном нарушении по микробиомно-кишечной-мозговой оси) в ходе исследования закономерностей положительных эффектов плохо всасывающегося в кишечнике антибиотика рифаксимина на течение печеночной энцефалопатии, было обнаружено, что улучшение состояния при применении этого препарата было обусловлено скорее сдвигами в метаболизме бактерий, чем изменениями в фактическом составе кишечной микробиоты.
Разумеется, разновидности бактерий, обитающие на поверхности слизистой или в слое слизи, более склонны к взаимодействиям с иммунной системой хозяина и кишечным барьером. Тогда как расположенные в просвете кишки больше влияют на метаболизм продуктов, участвующих в процессе кишечного пищеварения. Уже существуют доказательства наличия четких различий между этими популяциями как у здоровых, так и у больных .
Исследования роли микробиома в гомеостазе и в патофизиологии заболеваний продолжаются.
За последние годы многое стало известно о роли наших бактерий кишечника в поддержании здоровья. Неудивительно, что клинические и лабораторные исследования были устремлены на изучение связей между микробиомом кишечника и различными заболеваниями. Первоначально, по очевидным причинам, основное внимание уделялось заболеваниям желудочно-кишечного тракта, где уже были отмечены примеры воздействия аномальной микробиоты кишечника, проявляющиеся кишечными инфекциями, заболеваниями, связанными с наличием хеликобактера пилори и антибиотик-ассоциированной диареей. За последнее десятилетие мы получили доказательства, подтверждающие связь кишечной микробиоты с широким спектром психоневрологических, иммунологических и аллергических заболеваний. К примеру, измененная микробиота была выявлена во множестве разнообразных расстройств, от болезни Паркинсона и аутизма до диабета, астмы и целиакии .
Таким образом, за очень короткий промежуток времени исследования микробиома сместились от лаборатории к клинической практике, где их потенциал в облегчении диагностики, определении прогноза и лечебной тактики вызвал интерес среди исследователей и биомедицинской индустрии.
В основе веры в клиническую применимость информации о микробиоме лежат три предположения:
во-первых, мы знаем, каков он, микробиом, в норме;
во-вторых, мы можем точно и воспроизводимо определить патологию, вызванную изменением микробиома;
в-третьих, мы можем установить биологически достоверные и клинически значимые взаимоотношения между выявленным микробным профилем и рассматриваемым заболеванием.
Что же является нормой?
Определены факторы, позволяющие оценить, в какой степени такие параметры, как характер и условия родоразрешения, грудное или искусственное вскармливание, сроки, географическое расположение, питание, физическая нагрузка, употребление алкоголя или антибиотиков и возраст могут повлиять на любое понимание “нормы”.
На сегодняшний день диета вполне может быть главным определяющим многих исследований микробиома человека. Для микробиоты важен не только общий характер модели диеты (например, веганы в сравнении с вегетарианцами и в сравнении с “мясоедами” или подвергнутая глубокой обработке западная пища в сравнении с сельской африканской), но и относительные количества конкретных компонентов (углеводы, белки, жиры, клетчатка), влияющих на энтеротипы.
Привычная диета может надолго обеспечить формирование микробиоты. Но и кратковременные изменения в рационе, например, у людей с желудочно-кишечными заболеваниями, в том случае, если они будут достаточно существенными, также могут повлиять на изменения бактериального разнообразия и энтеротипа кишечной экосистемы.
Влияние грудного молока на микробиоту новорожденных и старших детей, опосредованное его собственным бактериальным “населением”, а также олигосахаридами-пребиотиками, представляет собой еще один яркий пример воздействия факторов окружающей среды на становление энтеротипа микробиоты кишечника.
Вносить изменения могут и другие терапевтические агенты. Антибиотики — очевидные источники проблем. Хорошо описан эффект их различных терапевтических доз.
Менее регистрируемые, но потенциально гораздо более влияющие на микробиом кишечника изменения оказывают дозы антибиотиков, используемых в животноводстве, которые мы получаем с мясом животных и птицы, с яйцами, что описано на экспериментальных моделях животных. Поскольку с каждым днем все подробнее описываются изменения микробиоты кишечника, связанные с применением других лекарственных средств, нам следует подготовиться к неожиданностям.
Следует также знать и помнить о существовании связи в человеке между кишечником и мозгом, так называемой осью микробиота-кишечник-мозг. Сейчас она рассматривается как имеющая взаимовлияние или двунаправленность, о чем свидетельствуют эффекты, которые оказывает стресс на физиологию кишечника, иммунитет и состав кишечной микробиоты.
Между микробиотой кишечника, кишечником (включая его иммунную и нервную системы, а также барьерную функцию) и мозгом происходит двунаправленное взаимодействие.
Роль микробиоты в желудочно-кишечных заболеваниях
На фундаментальном уровне многие из этих расстройств, видимо, связаны с переменным взаимодействием между нормальной и патологической микробиотой кишечника, продуктами микробного метаболизма, геномом хозяина (регулирующим такие факторы, как иммунный ответ), кишечным барьером (в широком смысле), иммунным ответом организма хозяина, его физиологией, а также с диетой и другими факторами микро- и макроокружения.
Учитывая, что многие из этих взаимодействий связаны и двунаправлены, не сложно оценить, с какими трудностями сталкивается исследователь, пытаясь понять роль микробиоты кишечника в возникновении изучаемого заболевания.
Однако был достигнут определенный прогресс.
Было показано, что характер взаимодействия между факторами патогенности бактерий, геномом хозяина и его иммунным ответом в значительной мере влияет на формирование фенотипа заболеваний, возникающих при инфицировании Helicobacter pylori, а также при связи как с болезнью Крона, так и с язвенным колитом.
Некоторые заболевания, по представлениям исследователей, “исходят ” из самого кишечника по причине нарушения его “герметичности”, то есть нарушения барьерной функции стенок кишечника.
В крайне упрощенном понимании, в нарушении барьерной функции кишечника часто обвиняются желудочно-кишечные и системные расстройства, вызываемые или опосредованные микробиотой, в том числе патологической.
Так называемое нарушение “герметичности кишки” способствует проникновению бактерий или продуктов их жизнедеятельности (например, липополисахаридов бактерий) через поврежденный эпителий в портальный или системный кровоток, что приводит к сепсису или системному иммунному ответу. Несмотря на привлекательность этой гипотезы, она имеет некоторые несоответствия. Главное: в отличие от животных моделей, методы выявления бактериальной транслокации (проникновения бактерий и продуктов их жизнедеятельности через стенку кишечника) у людей оказались ненадежными из-за методических ограничений.
Некоторые продукты метаболизма бактерий играют решающие роли в патогенезе симптомов и даже в этиологии кишечных и системных заболеваний.
Желчные кислоты обладают сложной и двунаправленной связью с кишечной микрофлорой. С одной стороны, желчные кислоты оказывают бактериостатическое влияние на некоторые микроорганизмы, а потому лактобациллы и бифидобактерии приспособились уклоняться от их воздействия с помощью фермента гидролазы желчных кислот.
С другой стороны, переработка бактериями первичных желчных кислот приводит к образованию продуктов, которые, благодаря непрерывно растущему многообразию регуляторных функций, могут оказывать влияние на метаболизм хозяина и на иммунный ответ, а также на моторику и секреторную активность толстой кишки.
Например, показано, что:
хенодезоксихолевая кислота ускоряет транспорт в толстой кишке, как и поступающая в кишечник желчь;
а такие желчные кислоты, как холевая, хенодезоксихолевая и дезоксихолевая способствуют экспрессии глюкагон-подобного пептида-1, тем самым усиливая секрецию инсулина и фермента деиодиназы 2 типа (главный фермент конверсии Т4 в Т3) и, таким образом, усиливая термогенез.
Таким образом, при конкретном желудочно-кишечном заболевании возможны множественные взаимодействия. Но определение относительной значимости эффектов этих взаимодействий, хотя это и возможно на биологических моделях, все еще трудно воспроизводимо или вовсе не осуществимо на людях.
Как доказательство: при изучении роли микробиоты кишечника при печеночной энцефалопатии (при возможно первичном нарушении по микробиомно-кишечной-мозговой оси) в ходе исследования закономерностей положительных эффектов плохо всасывающегося в кишечнике антибиотика рифаксимина на течение печеночной энцефалопатии, было обнаружено, что улучшение состояния при применении этого препарата было обусловлено скорее сдвигами в метаболизме бактерий, чем изменениями в фактическом составе кишечной микробиоты.
Разумеется, разновидности бактерий, обитающие на поверхности слизистой или в слое слизи, более склонны к взаимодействиям с иммунной системой хозяина и кишечным барьером. Тогда как расположенные в просвете кишки больше влияют на метаболизм продуктов, участвующих в процессе кишечного пищеварения. Уже существуют доказательства наличия четких различий между этими популяциями как у здоровых, так и у больных .
Исследования роли микробиома в гомеостазе и в патофизиологии заболеваний продолжаются.
Источник: http://medach.pro/microbes/microbiology/microbi.../